Макет коробочки для сбора спорофоров миксомицетов
Методы изучения видового разнообразия миксомицетов :
Существует два подхода к изучению видового разнообразия миксомицетов: использование прямых и косвенных методов. К прямым можно отнести метод полевых сборов, а к косвенным – метод «влажной камеры».
Метод полевых сборов
Сбор спороношений в полевых условиях осуществляют обычно в течение всего бесснежного периода. Для этого при себе необходимо иметь:
- Коробку для помещения в них собранных спороношений. При этом удобно использовать спичечные коробку (схема сбора корбочки -скачать), т.к. в них обычно легко помещаются спороношения большинства видов, они обладают небольшой себестоимостью, а спороношения, которые в них помещены, достаточно быстро высыхают, что предотвращает их повреждение грибами;
- Нож для срезания фрагментов субстрата, содержащих спороношения миксомицетов. При это удобно использовать ножи с крупными и не сильно заточенными лезвиями, которые позволяют поддеть большие фрагменты субстрата и не нанести опасных травм при неаккуратной работе;
- Пластиковую коробку, которая необходима для помещения в нее не до конца сформировавшихся образцов спороношений, которые могут быть инкубированы в лаборатории до достижения ими зрелости;
- GPS-навигатор для определения точных координат мест сбора образцов;
- Фонарь для осмотра нижних поверхностей стволов упавших деревьев;
- Блокнот и ручку для записи информации об особенностях микроместообитания собранного образца.
Обнаруженные образцы спорокарпов помещают в спичечные коробки. Если спороношение не до конца созрело, его кладут в пластиковый контейнер на увлажненный лист фильтровальной бумаги. При этом для каждого образца изготавливается «от руки» черновая этикетка, содержащая информацию о дате и месте сбора, коллекторе, растительной ассоциации. Кроме того, на этикетке можно указывать особенности микроместообитания данного образца: тип субстрата (кора живых или мертвых деревьев, древесина, опад), порода дерева (или хотя бы хвойное дерево или лиственное), степень разложения древесины, положение на бревне, освещенность, ассоциированные организмы, открытость для ветра и другие показатели.
В лаборатории зрелые спороношения помещают в теплое, сухое место вдали от прямого солнечного света, коробку приоткрывают, но образцы не достают. Незрелые спорангии, если их удалось донести до лаборатории неповреждеными, аккуратно вынимают из контейнера, помещают на увлажненную фильтровальную бумагу и накрывают стеклянным колпаком. Обычно процесс окончательного формирования спороношений занимает от нескольких часов до 2-3 дней. После чего образцы подсушивают по вышеизложенной методике.
Метод «влажных камер»
Метод «влажных камер» основан на получении из фрагментов субстратов растительного или животного происхождения в лабораторных условиях спороношений миксомицетов из покоящихся стадий. Таким образом, процесс получения спороношений можно разделить на два этапа: сбор образцов субстрата и постановка «влажных камер».
1) Сбор образцов субстрата для постановки «влажных камер».
Для постановки «влажных камер» подходит практически любой мертвый субстрат растительного происхождения: листовой опад, сухая трава, мелкие фрагменты валежа, кора живых деревьев, гнилая древесина, а также сильно выветрившийся помет растительноядных животных. Если исследование проводится с целью выявления видового разнообразия миксомицетов, сборщик должен отобрать в пределах исследуемого биотопа максимально возможное разнообразие исследуемых субстратов.
Фрагменты субстрата помещают в бумажные конверты, на которых указывают дату сбора, коллектора, тип субстрата, особенности биотопа и GPS-координаты. Использование пластиковых пакетов не рекомендуется, поскольку в них достаточно сложно обеспечить быстрое высыхание субстрата. При сборе коры с живых деревьев, необходимо аккуратно срезать омертвевшие фрагменты коры стараясь не повреждать живые ткани растения. Это связано с тем, что попадание живых растений во «влажную камеру» приводит к массовому развитию грибов, что отрицательно сказывается на возможности появления внутри таких чашек спороношений миксомицетов. По этой же причине нельзя допускать попадания в образец фрагментов живой травы при сборе омертвевших растительных остатков или травы. Собранные фрагменты субстрата высушивают при комнатной температуре в сухом месте, вдали от прямого солнечного света.
2) Процесс инкубирования «влажных камер».
Для работы с «влажными камерами» удобно использовать стандартные 9-ти см стеклянные чашки Петри. При работе с пластиковыми чашками обычно происходит очень быстрое высыхание камеры. В случае крайней необходимости работы с пластиковыми чашками, можно избежать быстрого высыхания закрывая ее по краю фрагментом парафильма (Parafilm TM) или пищевой пленкой, однако это обычно требует слишком много времени.
На дно чашки Петри помещают фильтровальную бумагу, сверху выкладывают фрагменты исследуемого субстрата. При этом фрагменты гнилой древесины и коры выкладывают таким образом, чтобы ее верхний слой был обращен наверх. Это делается для того, чтобы спороношения, образующиеся из покоящихся стадий, находящихся в складках коры, формировались на верхней, обращенной к исследователю, поверхности субстрата. Наиболее хороший результат дает помещение в камеру такого количества субстрата, чтобы его фрагменты располагались максимально плотно, но при этом не налегали один на другой, поскольку в противном случае при просмотре можно пропустить образовавшиеся спороношения, т.к. они будут заслонены другими частями исследуемого образца. Разложенные по поверхности фильтровальной бумаги фрагменты исследуемого субстрата поливают водой с таким расчетом, чтобы ее хватило на то, чтобы он полностью пропитался, но при это после смачивания, в камере не оставалось большое количество капельножидкой воды. Камеру закрывают крышкой с этикеткой, на которой указывается дата постановки и данные о дате и времени сбора, которые были отмечены на конверте.
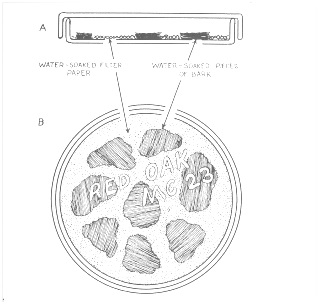
Рис. 1. Метод "Влажной камеры" (Stephenson, Stempen, 2000)
Первую проверку камер проводят на третий день после начала инкубирования с использованием бинокуляра. При этом сборщик должен внимательно осматривать всю поверхность субстрата, помещенного во «влажную камеру», а также внимательно осматривать стенки и верхнюю крышку чашки Петри, поскольку в некоторых случаях спороношения образуются и на них. Обнаруженные спороношения помещают в спичечные коробку с небольшим фрагментом субстрата, на котором они развивались. Если спорофоры развивались на стекле (крышке или стенках чашки Петри), то их не высушивая аккуратно срезают используя скальпель или препаровальную иглу и переносят на кусочек бумаги, на который предварительно была нанесена капелька клея. При необходимости, после просмотра в чашку доливают небольшое количество воды, чтобы препятствовать высыханию. При первом просмотре необходимо сливать излишки воды, которая не впиталась в субстрат. При этом иногда замеряют уровень pH в камере. Для этого электрод опускают в слитые из камеры излишки воды.
После первой проверки, камеры просматривают один раз на 5 день, следующий просмотр проводят на 7, 10, 15 и затем через 7-10 дней в течение трех месяцев. При этом все факты обнаружения следов жизнедеятельности миксомицетов отмечают на этикетке на чашке Петри. Это могут быть следы от проползшего по поверхности субстрата плазмодия, сам плазмодий или спороношения. В случае невозможности собрать из камеры все спороношения, которые там образовались, в образец помещают небольшой фрагмент субстрата, содержащий спорофоры, а в сопроводительной этикетке указывается примерное число обнаруженных в чашке спороношений.
По истечении трех месяцев производят последний осмотр чашек и те, в которых не отмечены следы пребывания миксомицетов, освобождают от остатков исследуемого субстрата и фильтровальной бумаги, после чего моют с использованием поверхностно активных веществ, а потом подсушивают в сушильном шкафу при температуре 90 градусов Цельсия. Поскольку у некоторых видов процесс развития плазмодия в спороношения может занять более 3 месяцев, камеры, в которых были обнаружены свежие спороношения и плазмодии, оставляют для дальнейшего инкубирования и убирают их только в случае, если в течение двух просмотров (около 20 дней) в них не было обнаружено новых спороношений и/или плазмодия. Показано, что более длительное культивирование «влажных камер» дает возможность получить дополнительные образцы и увеличить число полученных видов (Bezerra et al., 2008). Однако обычно наиболее продуктивным такое длительное инкубирование «влажных камер» оказывается при исследовании образцов копромы. При работе с другими типами субстратов как правило нет необходимости продолжать процесс культивирование более чем 3 месяца.
Таким образом, в результате полевых сборов и с использованием метода «влажной камеры» удается получить высушенные образцы спороношений миксомицетов.
Преимущества и недостатки метода «влажных камер» и полевых сборов
И метод «влажных камер» и метод полевых сборов имеют ряд достоинств и недостатков.
Метод полевых сборов:
Основные преимущества:
1. Метод полевых сборов позволяет проводить сравнительно непродолжительные по времени работы по установлению видового разнообразия миксомицетов.
2. Некоторые эколого-трофические группы миксомицетов выявляются исключительно методом полевых сборов, например, нивальные миксомицеты.
3. В ходе полевых сборов достаточно часто обнаружить крупные спороношения миксомицетов, которые удобно использовать в качестве демонстрационного материала в ходе практических занятий.
Основные недостатки:
1) Невозможно судить о субстратной приуроченности выявленных видов. Дело в том, что как уже было сказано выше, при формировании спороношения у плазмодиев меняются таксисы, в результате чего иногда они могут формировать спороношения на тех субстратах, где не проходила ни одна из стадий их жизненного цикла. И если образцы того или иного вида имеют приуроченность к листовому опаду или гнилой древесине, это не означает, что трофические стадии развивались именно на этом типе субстрата.
2) К сожалению, в ходе полевых сборов на практике достаточно сложно добиться стандартизации экспериментов. Обычно спороношения миксомицетов в большом количестве удается обнаружить на гнилой древесине, реже – на листовом опаде и коре живых деревьев. Обычно гнилая древесина рассеяна в лесу крайне неравномерно. В результате чего, при случайном выборе пробной площади для сравнения биотопов, получается, что в одной из них находится крупное гниющее дерево, на котором можно обнаружить до 10-15 видов, а на другой площадке при случайном выборе наиболее подходящий фрагмент субстрата не попадает в пределы пробной площади. Таким образом, сравнивать между собой даже крупные пробные площади не вполне корректно. Еще один способ стандартизовать процесс сбора спороношений – производить сбор спороношений в пределах одного биотопа в течение определенного, стандартного, промежутка времени. Однако и в этом случае также не удается добиться стандартных исследований, опять-таки из-за гетерогенности субстратов, подходящих для сбора спороношений в пределах одного биотопа. Таким образом, метод полевых сборов имеет ряд ограничений и не всегда хорошо подходит для исследований экологии этой группы организмов.
3) Для выявления наиболее полного видового разнообразия миксомицетов необходимо проводить исследования в течение всего бесснежного периода, поскольку разные виды миксомицетов образуют спороношения в разное время года.
4) Методом полевых сборов достаточно часто невозможно обнаружить мелкие и эфемерные спороношения миксомицетов. Так, Echinostelium minutum, до появления «влажных камер», считался чрезвычайно редким видом (Lister, 1925). Однако сейчас показано, что этот вид имеет очень широкую экологическую амплитуду и распространен практически повсеместно, однако из-за наличия достаточно мелких (200-400 мкм выс. и 50-70 мкм в диам.) спороношений, его чрезвычайно редко удается обнаружить в полевых условиях.
5) В некоторых климатических зонах, например, аридных или в условиях крайнего севера, практически невозможно обнаружить спороношения в полевых условиях, т.к. они в большинстве случаев представлены видами, образующими эфемерные спороношения, которые незаметны при полевых сборах.
Таким образом, метод полевых исследований наиболее хорошо подходит для составления предварительных чек-листов, а также для выполнения учебных работ – одной их основных задач которых является демонстрация в природных условиях спороношений миксомицетов и обучение методу сбора и идентификации собранного материала.
Метод «влажных камер»:
Основные преимущества:
1. Метод «влажных камер» позволяет стандартизировать сборы спороношений. Несмотря на все разнообразие возможных типов растительных субстратов, их можно разделить на несколько более или менее гетерогенные группы и проводить сравнения видового разнообразия на разных типах субстрата. Кроме того, чашка Петри имеет стандартную площадь поверхности (63 кв. см в чашке Петри диаметром 9 см), на которой могут быть распределены исследуемые фрагменты субстрата. Именно с использованием метода «влажных камер» наиболее правильно сравнивать видовое разнообразие различных биотопов.
2. Эксперименты с изоляцией фрагментов участков коры полиэтиленовыми пакетами, проведенные Л. Пендерграссом (Pendergrass, 1976), показали, что во «влажных камерах» происходит формирование спороношений не из спор, а из покоящихся стадий (склероциев и микроцист). Таким образом, этим методом можно установить субстратную приуроченность этих покоящихся стадий, образованных из трофических, а следовательно, можно делать выводы о субстратной приуроченности обнаруженных видов.
3. Несомненным преимуществом этого метода является возможность проводить исследования в любое время года и вдали от места сбора образцов. Более того, предполагается, что время года для сбора образцов субстратов не является важным фактором (Stephenson, Stempen, 2000). Более того, специально были проведены исследования убедительно показывающие, что видовой состав миксомицетов не зависит от высоты, с которой была взята кора с дерева (Snell, Keller, 2003). Однако можно предположить, что на видовое разнообразие миксомицетов может оказывать влияние взятие образца с разных сторон света или роза ветров (обычно на коре, которая обращена на север имеется повышенная влажность и, как следствие, развиваются особые группировки организмов, например, мхи, водоросли и т.д.). Для избегания подобных ошибок, обычно кору с дерева рекомендуют собирать небольшими фрагментами по кругу, в результате чего получается смешанный образец, содержащий кору со всего диаметра ствола.
4. Метод «влажных камер» позволяет обнаружить эфемерные спороношения миксомицетов, которые не удается обнаружить при полевых сборах.
Основные недостатки:
1. Метод «влажных камер» является чрезвычайно трудоемким. Для успешной работы требуются значительные временные затраты, а также определенная периодичность проведения работ. От момента сбора материала до момента появления первых результатов проходит не менее 4-5 месяцев. При планировании эксперимента необходимо учитывать, что просматривать одновременно более 200 камер достаточно проблематично. При таком объеме работ на одну проверку обычно уходит несколько рабочих дней.
2. Довольно часто во «влажных камерах» спороношения образуются в малых количествах (1-2 спороношения), в результате чего после определения, где зачастую приходится приготавливать препараты капиллиция и спор, не остается материала для подтверждения обнаружения того или иного вида. В таких случаях необходимо прибегать к изготовлению полупостоянных препаратов, а также к фотографированию и описанию морфологии подобных спороношений.
3. Во «влажных камерах» часто развиваются аберрантные спороношения. При этом, в недоразвитых образцах могут присутствовать споры большего диаметра, а капиллиций иметь не типичное строение.
4. Крупные спороношения миксомицетов, которые постоянно встречаются в ходе полевых сборов, практически никогда не обнаруживают во «влажных камерах». К примеру, в ходе изучения видового разнообразия миксомицетов Москвы и Московской области было поставлено 1845 «влажных камер». За все время исследований такой широко распространенный вид как Lycogala epidendrum был отмечен в них лишь однажды, а Hemitrichia clavata, Trichia persimilis, T. scabra и многие другие широко распространенные виды во «влажных камерах» не образовывались (Гмошинский, 2013). Возможно, причина этого заключается в том, что плазмодию необходмо достигать определенных размеров для перехода к формированию спороношений.
Таким образом, метод «влажной камеры» можно использовать в длительных исследованиях, которые могут проводиться удаленно от места сбора материала. Он позволяет произвести стандартизацию эксперимента. Однако все-таки основным его недостатком является трудоемкость постановки камер и сложности при определении полученного материала.
Концепция учетной единицы при изучении видового разнообразия миксомицетов
В ходе определения видового разнообразия миксомицетов часто возникает вопрос, что принимать за учетную единицу (образец). К одному образцу может быть отнесен спорокарп или группа спорокарпов, образованные из одного плазмодия (Stephenson, 1988). Нередко получается так, что непосредственно перед формированием спороношений плазмодий может фрагментироваться и формировать несколько групп спороношений на одном субстрате. Поэтому при полевых сборах за учетную единицу можно принимать все спороношения данного вида, образованные на одном субстрате (одном бревне, на коре одного дерева, в пределах одной колонии при развитии на земле или листовом опаде). При получении образцов методом «влажной камеры» за один образец можно принимать все спорокарпы данного вида, образованные из одного пакета с субстратом. Предположим, что из одного пакета было поставлено несколько повторностей «влажных камер». В ходе проверок в каждой из них могут формироваться спороношения одного и того же вида. Однако поскольку субстрат был более или менее гомогенным, можно предположить, что все образцы сформировались из одного плазмодия, а следовательно, они должны рассматриваться как один и тот же образец (Матвеев и др., 2014).
Идентификация собранных образцов
Несомненным удобством в определении спороношений миксомицетов является то, что все необходимые признаки, которые нужны для идентификации видовой принадлежности, сохраняются в высушенных спороношениях. В отличии от многих групп грибов, не требуется составление прижизненных описаний цвета, запаха, вкуса, а также нет необходимости знать тип субстрата, на котором был обнаружен данный вид.
Для определения видовой принадлежности миксомицетов необходимо иметь:
- Микроскоп с предварительно промеренным окуляр-микрометром и, желательно, с фото-насадкой;
- Бинокуляр, также желательно с фото-насадкой;
- Тонкие пинцеты;
- Препаровальные иглы (2 шт. с прямыми и 2 с загнутым кончиком);
- Предметные стекла;
- Покровные стекла;
- Водный раствор 2-4% KOH, в котором приготавливают микропрепараты. Использование слабого раствора щелочи обусловлено гидрофобностью спор миксомицетов.
Гербаризация собранных образцов
Образцы спороношений могут быть занесены в коллекцию, что значительно повышает ценность подобных исследований.
Обычно гербарный образец представляет собой коробочку, содержащую фрагмент субстрата, на поверхности которого находятся спороношения миксомицетов. Для сохранности спороношений рекомендуют приклеивать спорофоры на дно коробка при помощи клея (рис. 2). Как правило с этой целью используют прозрачный резиновый клей «Момент-Кристалл», поскольку он достаточно долговечен, почти не токсичен, мало заметен в образце и образует небольшую липкую каплю, к которой удобно крепить небольшой фрагмент субстрата.
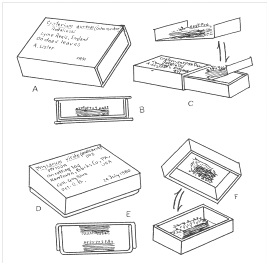
Рис. 2. Гербаризация собранного материала (Stephenson, Stempen, 2000)
Для того, чтобы гербарий выглядел более аккуратным рекомендуют обклеивать коробки по кругу белой бумагой. Для этого удобно использовать более дешевый клей ПВА. На дно коробка обычно также прикрепляют небольшой фрагмент белой бумаги, к которой уже крепят образцы спороношений. На поверхность коробка приклеивают чистовую этикетку, содержащую информацию о названии вида, месте, дате сбора, методе получения образца, ФИО коллектора и определившего образец. Кроме того, коробок обычно снабжается номером, который присваивается ему при занесении в базу данных.
Процесс формирования гербария – очень трудоемкий и требует аккуратности и большого терпения. Обычно в ходе крупного исследования удается обнаружить более 1000 образцов со спороношениями, которые необходимо каким-либо образом сохранить. Для того, чтобы сохранить число гербарных образцов обычно поступают следующим образом:
- Если при полевых сборах в пределах одного биотопа в один и тот же день было обнаружено несколько образцов одного и того же вида, то такие образцы обычно помещают в одну гербарную коробку. Если спороношения крупные и не помещаются в ней, то обычно на дно гербарного образца наклеивают небольшие фрагменты спороношений каждого из образцов. При этом на этикетке указывают, сколько полевых образцов помещено в коллекцию в одном гербарном образце.
- Иногда образцы спороношений достаточно небольшого размера. Тогда в одну гербарную коробку можно поместить сразу 2-3 образца спороношений разных видов. При этом желательным для этих образцов является обнаружение их в одном биотопе. При этом внутри коробка их необходимо располагать так, чтобы они не налегали один на другой. Внутри коробка каждый вид подписывают, а на чистовой этикетке указывают информацию обо всех видах.
Простейшие методы культивирования миксомицетов в лабораторных условиях
Существует множество методов и питательных сред для культивирования миксомицетов в лабораторных условиях (Haskins, Wrigley de Basanta, 2008). Многие питательные среды основаны на использовании разнообразных экстрактов (в т.ч. морковного (Indira, 1969) и овсяного (Haskins, Wrigley de Basanta, 2008). Существуют полностью синтетические питательные среды, как, к примеру, среда Даниэля (Daniel, Baldwin, 1964), а также среды на основе широко распространенных микробиологических добавок (например, SM/2-агар (Sussman, 1966)). Благодаря разработанным методикам, в последние годы удается получить чистые культуры тех видов, которые ранее считалось выделение которых в лабораторных условиях ранее считалось невозможным (Shchepin et al., 2014). Однако эти методы требуют поддержания стерильных условий и определенного набора реактивов. Ниже мы приводим самые элементарные методики, практически не требующие специального оборудования.
Проращивание спор миксомицетов
Проращивание спор миксомицетов осуществляют обычно на 1,5 % голодном агаре (15 гр. агара на 1 л воды; стерилизация при 1 атм., 30 минут). Среду стерильно разливают в чашки Петри и добавляют 1 мл водной суспензии спор. В зависимости от вида и возраста спор, прорастание происходит в период от нескольких часов до нескольких дней. Для того, чтобы проконтролировать прорастание спор, вырезают небольшие кусочки агара, помещают их на предметное стекло и просматривают на малом увеличении микроскопа (*4 и *10), не накрывая покровным стеклом. В некоторых случаях уже после прорастания спор добавляют смыв бактерий, которые могут быть использованы миксамебами в качестве источника пищи.
Культивирование плазмодия
Для культивирования плазмодия в учебных целях лучше всего подходит относительно простой метод Кэмпа, который заключается в получении живых плазмодиев на фильтровальной бумаге, на которую в качестве источника питательных веществ наносят небольшое количество перемолотых овсяных хлопьев (Camp, 1936), при чем следует учитывать, что для культивирования плазмодиев не подходят овсяные хлопья быстрого приготовления и/или с ароматическими добавками. Процесс культивирования не требует соблюдения стерильных условий. Для него очень хорошо подходят бывшие в употреблении пластиковые чашки Петри, на дно которых помещают фильтровальную бумагу (1-2 слоя), добавляют небольшое количество перемолотых в муку овсяных хлопьев (не более 0,25 гр.) и заливают небольшим количеством воды. В центр чашки помещают небольшой фрагмент субстрата с плазмодием. Далее чашку надписывают и по краю закрывают пищевой пленкой или парафильмом (ParafilmTM) во избежание быстрого высыхания. В некоторых случаях плазмодий достаточно быстро увеличивается в размерах и уже спустя 5-7 дней его можно разделить на 2-3 части и перенести в новые чашки. При этом плазмодий переносят непосредственно на фильтровальной бумаге. Таким образом удается поддерживать жизнеспособность плазмодиев на срок до нескольких лет. Более того, некоторые виды при постепенном высушивании образуют склероции, которые могут длительное время сохранять жизнеспособность.
Образцы плазмодиев можно получить либо при работе с «влажными камерами», где они достигают подчас довольно крупных размеров, либо можно попытаться выделить в культуру плазмодий, обнаруженный в ходе полевых сборов. В большинстве случаев получить крупные плазмодии в результате проращивания спор не получается, поскольку часто их формированию должен предшествовать половой процесс, в то время как многие штаммы миксомицетов гетероталличны (Clark, Stephenson, 1990; Clark, Haskins, 1998; Clark et al., 2003; Clark et al., 2004).
Лит:
1) Гмошинский В.И., Дунаев Е.А., Киреева Н.И. Определитель миксомицетов Москвы и Московской области. М.: изд-во МГУ. 2016. (в печати).
2) Stephenson S.L. Myxomycetes. A handbook of slime molds / S.L. Stephenson, H. Stempen. - Portland, Oregon: Timber Press, 2000. - 109p.
МЕНЮ :
Методики сбора, гербаризации и определения миксомицетов
Съезды, симпозиумы, экспедиции и проведенные конференции